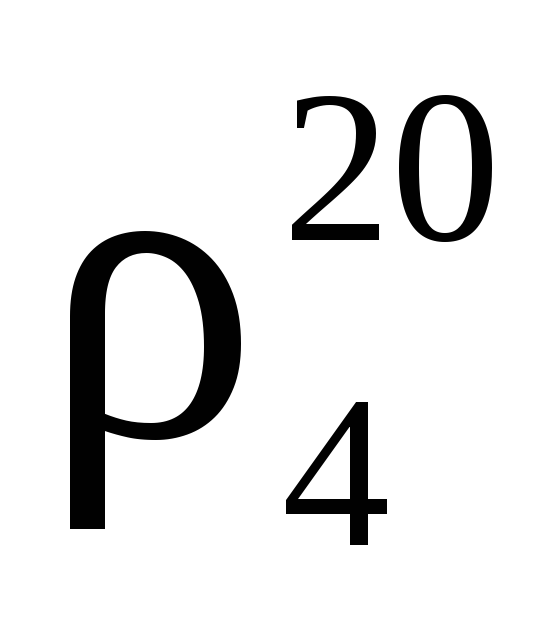Федеральное агентство по образованию Государственное
образовательное учреждение высшего профессионального
Образования (ГОУ ВПО)
Уфимский государственный нефтяной технический
университет Филиал УГНТУ в г. Салавате
Общая химия
Отчет по лабораторной работе
«ПРИГОТОВЛЕНИЕ РАСТВОРОВ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ»
ХТП-140610.65-01.03.000 ЛР
Исполнитель:
студент гр. АП-08-21 Д. С. Андреев
Руководитель:
ассистент Р. Р. Вахидов
Салават 2008
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Цель работы: Приготовление раствора заданной концентрации и определение процентной концентрации данного раствора.
Опыт 1. Приготовление раствора заданной концентрации из навески
Этот способ применяется главным образом для приготовления растворов солей.
1 Концентрация раствора K 2 Cr 2 O 7 указана в таблице 1
2 Рассчитайте массу вещества, необходимое для приготовления раствора заданной концентрации, взвесьте его на технических весах с точностью до 0,01 г.
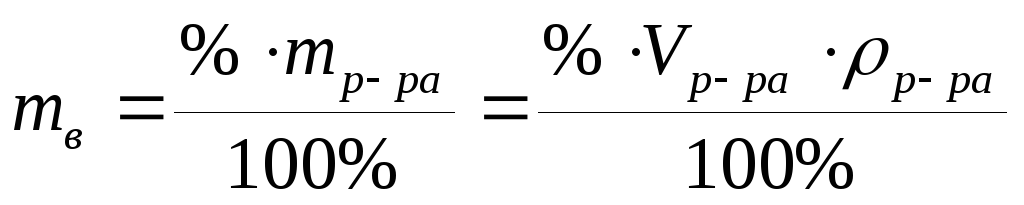
 г
г
Плотность полученного раствора – 1.02 г/см 3 .
3 Возьмите плоскодонную колбу и через воронку осторожно перенесите в нее навеску соли. Воду, отмеренную для растворения, вылейте через воронку в колбу небольшими порциями так, чтобы всю соль с воронки смыть в колбу. Закройте пробкой колбу, встряхните её несколько раз, чтобы вся соль полностью растворилась.
4 Измерьте плотность полученного раствора ареометром и проверьте по таблице правильность приготовления раствора. Для этого перелейте приготовленный раствор в цилиндр и осторожно опустите ареометр. Затем выньте ареометр и промойте его под водопроводной водой.
Таблица 1 – Концентрация раствора K 2 Cr 2 O 7
Опыт 2. Определение процентной (масс) концентрации раствора и пересчет её на молярную и процентную концентрацию
1. В стеклянный
цилиндр с раствором соли плавно опускают
ареометр, так, чтобы он не касался стенок
сосуда. Плотность равна
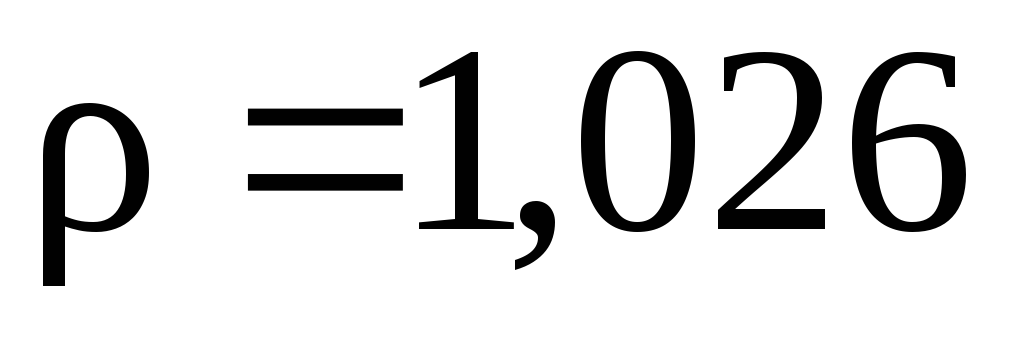
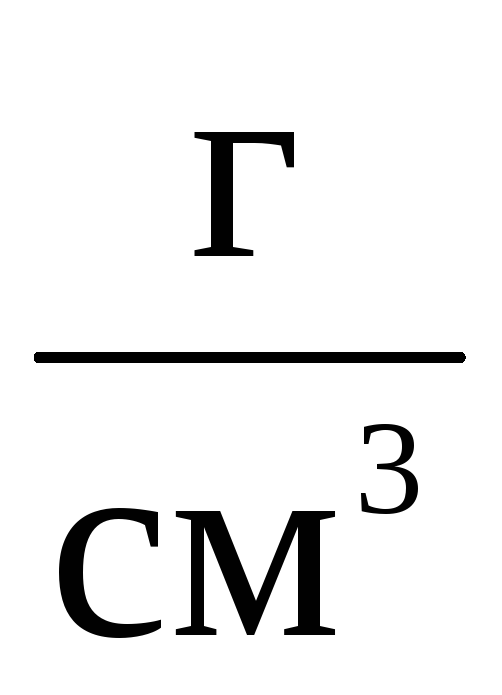 .
.
2. По таблице 2 находят процентную концентрацию раствора. Если найденная плотность находится между двумя значениями в таблице, то процентную концентрацию находят интерполяцией по уравнению
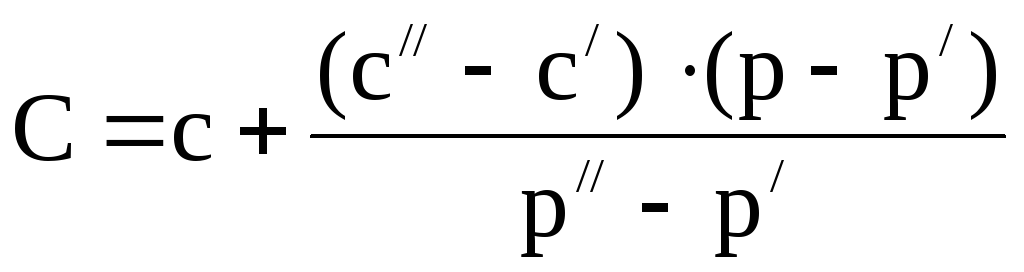 ,
,
где
 – процентная концентрация,
– процентная концентрация,
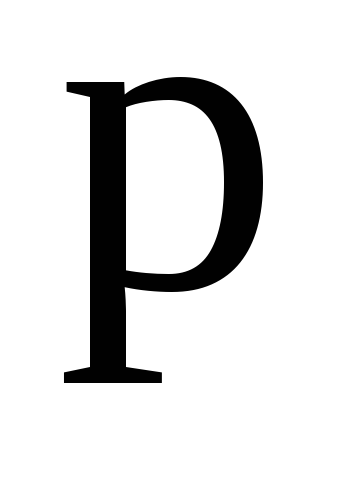 –плотность
раствора,
–плотность
раствора,
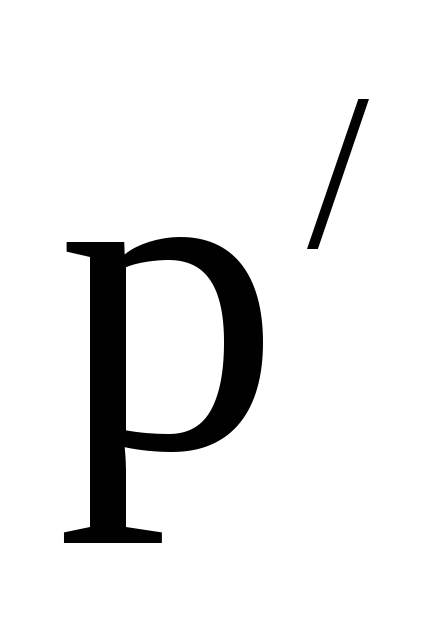 –ближайшее
меньшее значение плотности в таблице,
–ближайшее
меньшее значение плотности в таблице,
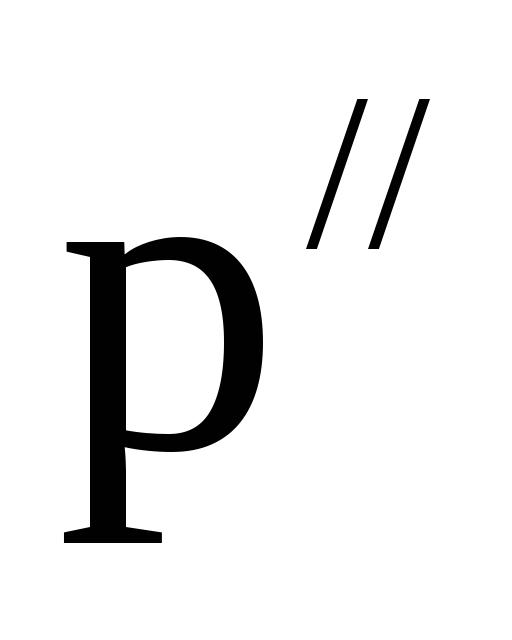 –ближайшее
большее значение плотности в таблице,
–ближайшее
большее значение плотности в таблице,
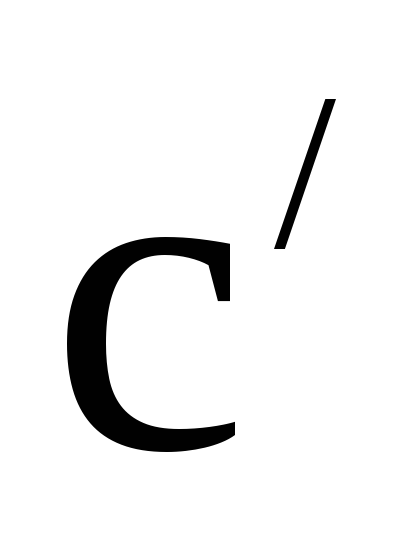 –%
– концентрация раствора с плотностью,
–%
– концентрация раствора с плотностью,
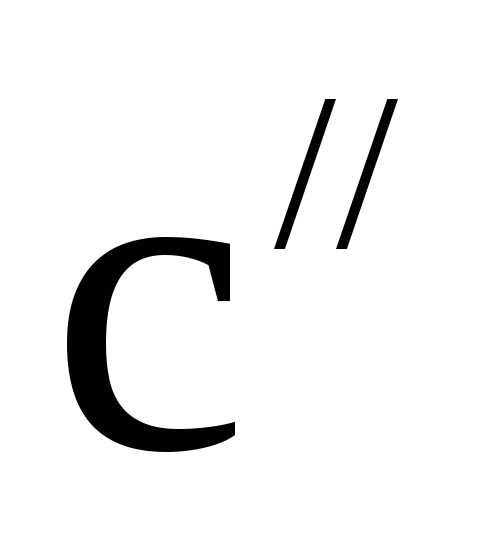 –%
– концентрация раствора с плотностью.
–%
– концентрация раствора с плотностью.
По рассчитанной процентной концентрации определяют молярность и нормальность раствора.
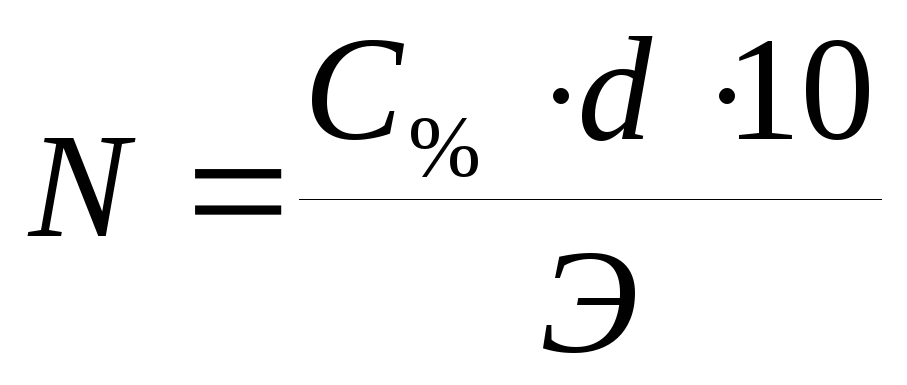 ,
,
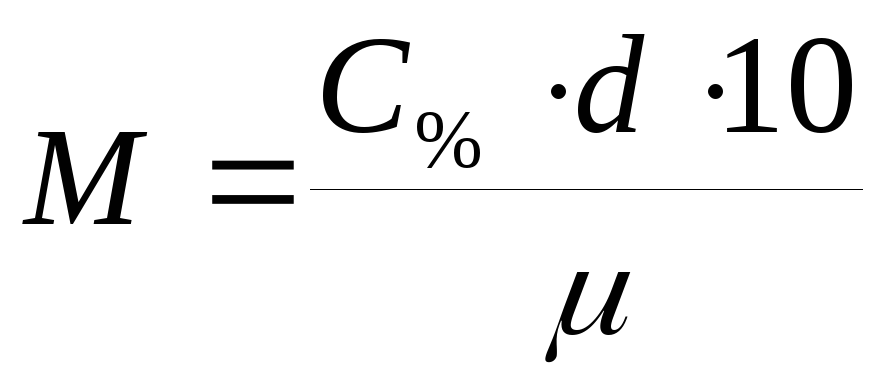 ,
,
где
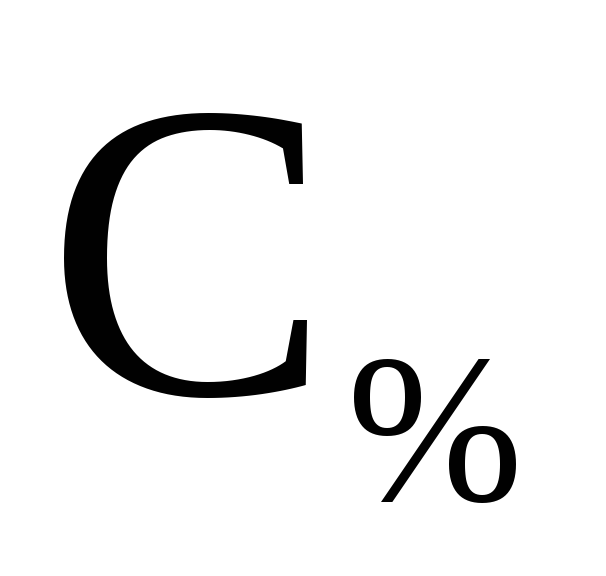 – рассчитанная процентная концентрация
соли(2),
– рассчитанная процентная концентрация
соли(2),
 –соответствующая
плотность(1.0045),
–соответствующая
плотность(1.0045),
 –значение
эквивалента соли(53.5),
–значение
эквивалента соли(53.5),
 –молярная
масса соли(53.5).
–молярная
масса соли(53.5).
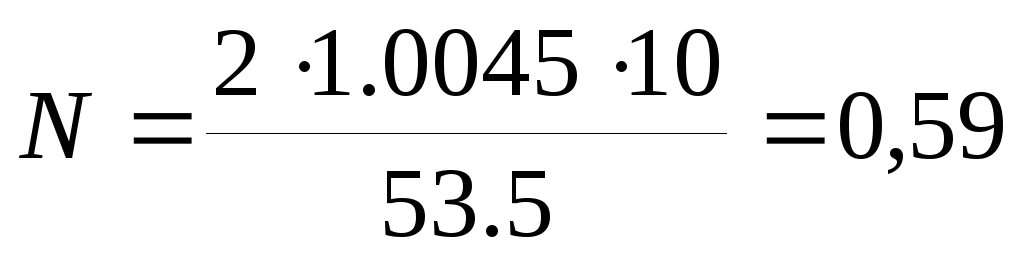

Таблица 2 – Процентная концентрация раствора
|
|
Вывод: мы научились приготовлять растворы заданной концентрации и определять процент концентрации данного раствора. При выполнение первого опыта процент ошибки составило 0.06%. Во втором опыте процентная концентрация NH 4 Cl равно двум.
Вопросы и задачи.
1.Что называется концентрацией раствора и способы её выражения. Дать определение и показать на примерах.
Концентрация растворов называется количество растворенного вещества, содержащегося в определенном количестве раствора и растворителя. Существуют следующие способы выражения концентрации:
а) процентная (С%), %
б) мольная (С м), моль/л.
в) эквивалентная (С н), экв./л.
г) титр (Т), г/мл.
д) моляльность (m), моль/1000г.
е) мольная доля (N)
Например: 1% раствор KCl – это такой раствор в 100г, которого содержится 1г KCl и 99г воды.
1М раствор H 2 SO 4 – это раствор H 2 SO 4 , в каждом литре которого содержится 1моль или 98% чистой H 2 SO 4 .
2Н раствор HCl – это раствор HCl, в каждом литре которого содержится 2экв. или 73г – HCl.
2.Сколько грамм KCl следует растворить в 100г воды для получения 5% раствора.
Дано: Решение
m(H 2 O)=100г C%=m 1 . 100% / m 1 +m 2
С%=5% 5%= m KCl . 100% / (m KCl + 100)
0.05(m KCl + 100) = m KCl
m(KCl) - ? m KCl =5.26г
Ответ: m KCl =5.26г
3.Какова процентная концентрация раствора, полученного в результате растворения 90г вещества в 180г воды?
Дано: Решение
m(H 2 O)=180г C%=m 1 . 100% / m 1 +m 2
m 1 =90г С%=90 . 100% / (90+180)
Ответ: С%=33.3%
4. В 240мл воды растворили 80г соли, d (H 2 0)=1г/мл. Какова процентная концен-трация соли?
Дано: Решение
d (H 2 0)=1г/мл С%= m(соли) . 100% / (m(соли)+ d (H 2 0) . V (H 2 0))
V (H 2 0)=240мл С%=80 . 100% / (80+240 . 1)=25%
m(соли)=80г
Ответ: С%=25%
5. Что означает 1Н Ca(OH) 2 , PbCl 3 , AgNO 3 ; 2M Al(OH) 3 , KNO 3 , CaCl 3
1Н Ca(OH) 2 – в 1л раствора растворено 1экв или 74/2=37г - Ca(OH) 2
1Н PbCl 3 - в 1л раствора растворено 1экв или 313.5/3=104.5г - PbCl 3
1Н AgNO 3 - в 1л раствора растворено 1экв или 170г - AgNO 3
2М Al(OH) 3 – в 1л раствора содержится 2моль или 78 . 2=156 - Al(OH) 3
2М KNO 3 - _ в 1л раствора содержится 2моль или 101 . 2=202г - KNO 3
2М CaCl 3 - в 1л раствора содержится 2моль или 111 . 2=222г - CaCl 3
Дано: Решение
С%=2% C=m100% / Vd
d=1.0347г/мл m=CVd / 100%
V=250мл m=2% . 250 . 1.0347 / 100%=5.17г
Ответ: 5.17г
Сколько грамм Na 2 SO 3 потребуется для приготовления 5л 8% раствора d=1.075г/мл.
Дано: Решение
C%=8% C=m100% / Vd
V=5л m=CVd / 100%
d=1.075г/мл m=8% . 5000 . 1.075 / 100%=430г
Ответ:430г
Чем объяснить устойчивость истинных растворов?
Истинные растворы - это растворы в которых размер частиц растворённого вещества менее 1нм. Из-за броуновского движения молекулы растворённого вещества (или атомы) не могут ассоциироваться в более крупные частицы. Этим и объясняется их устойчивость.
Чему равна молярность и нормальность 3% раствора FeCl 3 (d=1.037г/мл).
Дано: Решение
С%=3% См=С% . 10 . d / М М (FeCl 3)=162.5г/мл
d=1.037г/мл Cн= С% . 10 . d / Э Э(FeCl 3)=162.5/3=54г-экв.
См= 3 . 10 . 1.037 / 162.5=0.19М
См - ? Сн= 3 . 10 . 1.037 / 54=0.57Н
Ответ: См=0.19М Сн=0.57Н
10. Дать определение растворам.
Раствором называется гомогенная система переменного состава, состоящая из двух или большего числа компонентов, которые раздроблены до атомов, ионов или молекул. Существуют жидкие, твёрдые и газообразные растворы.
11.Раствор содержит смесь солей AgNO 3 ,Ba(NO 3) 2 и Zn(CH 3 COO) 2 . К нему добавили избыток HCl. Написать ионные уравнения возможных реакции.
AgNO 3 +HCl AgCl + HNO 3
Ag + + NO - 3 + H + +Cl - AgCl +H + + NO 3 -
Ag + + Cl - AgCl
Ba(NO 3) 2 +2HCl BaCl 2 +2HNO 3
Zn(CH 3 COO) 2 + 2HCl ZnCl 2 + 2 CH 3 COO
12.Написать уравнение ступенчатой диссоциации Н 2 S. В каком направление будут смещаться эти равновесия при добавлении HCl и NaOH
Н 2 S HS - +H +
Н 2 S S 2- +H +
В соответствии с принципом Ле Шателье равновесие смещается в сторону уменьшения (расхода) внешнего воздействия:
при добавлении NaOH равновесие сместится вправо (т.к. NaOH связывает H + с образованием воды)
При добавлении HCl равновесие сместится влево в сторону уменьшения ионов водорода H +
13. На нейтрализацию 25мл HCl неизвестной концентрации пошло 30мл 0.1Н раствора NaOH. Вычислить молярность, нормальность и титр раствора HCl.
Дано: Решение
V (HCl)=25мл Пользуясь тем, что объемы растворов реагирующих веществ
V (NaOH)=30мл обратно пропорциональны их нормальностям, рассчитываем
Сн(NaOH)=0.1Н нормальность HCl
См (HCl)-? V (NaOH) / V (HCl) = Сн (HCl) / Сн(NaOH)
Сн (HCl)-? Сн (HCl)=0.12Н
Т (HCl)-? Поскольку HCl одноосновная кислота то молярность и
нормальность равны.
См (HCl) = Сн (HCl) = 0.12Н
Т=Сн. Э / 1000 = 0.12 . 36.5 / 1000 = 0.0044г/мл
Ответ: Сн (HCl)=0.12, См (HCl)=0.12, Т=0.0044
14.Попарно смешали растворы следующих веществ:
NaCl + CH 3 COO NaClO + CH 3 COO
NaCl + KOH Na 2 SO 4 + NaOH
MgCl 2 + KOH NaHSO 4 + NaOH
Между какими возможны реакции обмена. Написать ионные уравнения возможных реакции.
MgCl 2 + 2KOH Mg(OH) 2 + 2KCL
Mg 2+ +2Cl - +2K + +2OH - Mg(OH) 2 + 2K + + 2Cl -
Mg 2+ +2OH - Mg(OH) 2
NaHSO 4 + NaOH H 2 SO 4 + H 2 O
Na + +H + +SO 4 2- + Na + +OH - 2H + + SO 4 2- + H 2 O
H + + OH - H 2 O
15. Какова нормальность 40% раствора H 2 SO 4 ; d=1.3г/мл
Дано: Решение
С%=40% Сн= С% . 10 . d / Э Э(H 2 SO 4)=48г-экв
d=1.3г/мл Сн= 40 . 10 . 1.3 / 48 = 10.8Н
Ответ: Сн = 10.8Н9 Лабораторная работа №8
Приготовление растворов заданной концентрации
Цель работы: приобретение навыков приготовления растворов заданной концентрации, выраженной различными способами, из сухой соли или более концентрированного раствора.
Оборудование и реактивы: конические колбы на 250 мл , технохимические весы, фильтровальная бумага, мерные цилиндры, набор ареометров, мерные колбы на 100 мл , сухие соли, например NaCl , KCl , Na 2 CO 3 , BaCl 2 , CaCl 2 , CuSO 4 .
9.1 Теоретические пояснения
Концентрация раствора – это относительное содержание растворенного вещества в растворе.
Рассмотрим некоторые способы выражения концентрации раствора.
− Массовая доля вещества w (Х).
Это безразмерная величина, равная отношению массы растворенного вещества m (X) к общей массе раствора m (р-ра):
w (Х)= . (9.1)
Часто массовую долю выражают в процентах и называют процентной концентрацией по массе:
w
%(Х)=
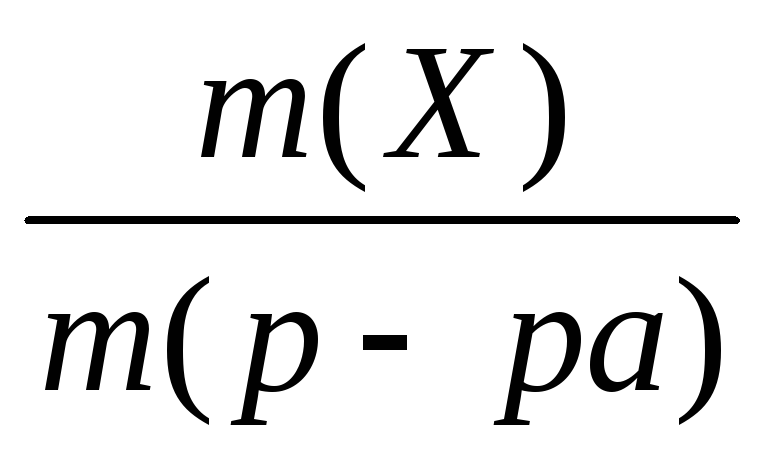 .
×
100%.
(9.2)
.
×
100%.
(9.2)
Массовую долю также можно выражать в промилле (0 / 00) – это 0,1%; в рр m – это 10 -4 % и в ррв – это 10 -7 % (одна часть на миллиард).
Массовая доля вещества, выраженная в процентах, показывает, сколько граммов данного вещества содержится в 100 граммах раствора.
− Молярная концентрация вещества или молярность
Обозначается С(Х). Это отношение количества растворенного вещества n (Х) , выраженного в моль , к объему раствора V , выраженному в литрах:
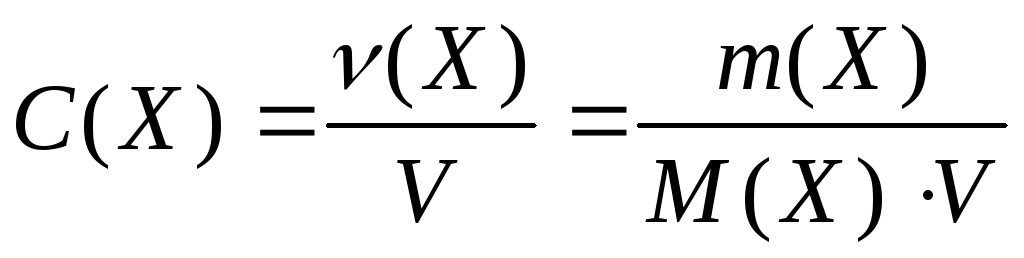 . (9.3)
. (9.3)
Молярная концентрация выражается в моль/л . В литературе часто встречаются сокращенные обозначения, например запись “1М раствор” означает раствор, имеющий концентрацию 1моль/л , его еще называют одномолярным раствором.
− Молярная концентрация вещества эквивалента
Обозначается С(1/ z X ). Эту концентрацию еще называют эквивалентной концентрацией, нормальной концентрацией или нормальностью. Она представляет собой отношение количества вещества эквивалента n (1/ z Х) , выраженного в моль , к объему раствора V , выраженного в литрах:
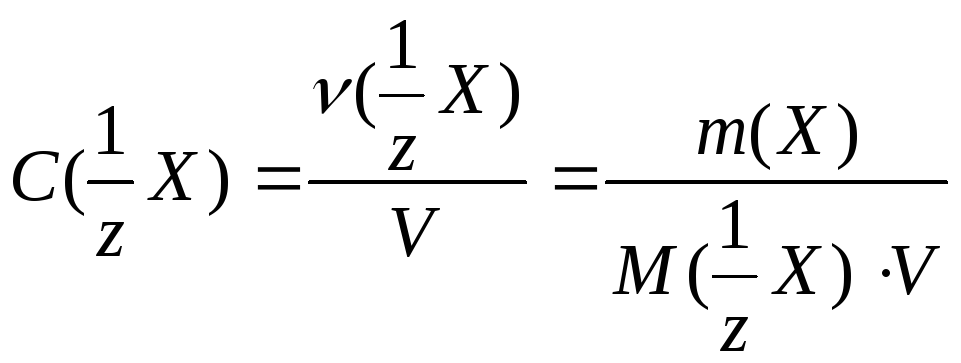 . (9.4)
. (9.4)
моль/л , иногда, чтобы подчеркнуть отличие от молярной концентрации, записывают моль экв./л . Возможны также сокращения, например запись “1н. раствор“ означает раствор, в одном литре которого содержится 1моль вещества эквивалента, такой раствор называют однонормальным.
Так как вещества взаимодействуют друг с другом в эквивалентных количествах, то для двух растворов взаимодействующих веществ выполняется равенство
V(X 1 ) × C(1/z 1 X 1 )= V(X 2 ) × C(1/z 2 X 2 ) (9.5)
Следовательно, растворы равной нормальности реагируют в равных объемах.
− Моляльная концентрация (моляльность)
Обозначается b (Х). Это отношение количества растворенного вещества n (Х) , выраженного в моль , к массе растворителя m , выраженной в килограммах:
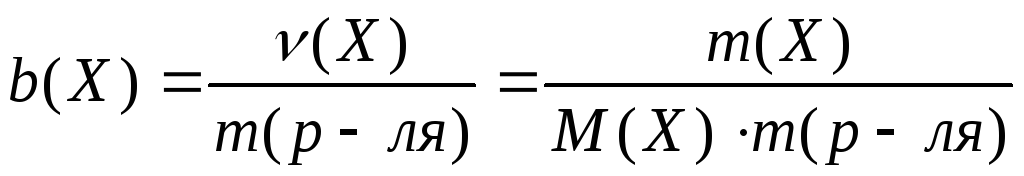 . (9.6)
. (9.6)
Данная концентрация выражается в моль/кг .
− Титр
Обозначается Т(Х) . Это масса растворенного вещества в граммах, содержащаяся в одном миллилитре раствора:
Т(Х)= m (X ): V . (9.7)
Титр выражается в г/мл (г/см 3 ).
− Молярная доля (мольная доля)
Обозначается
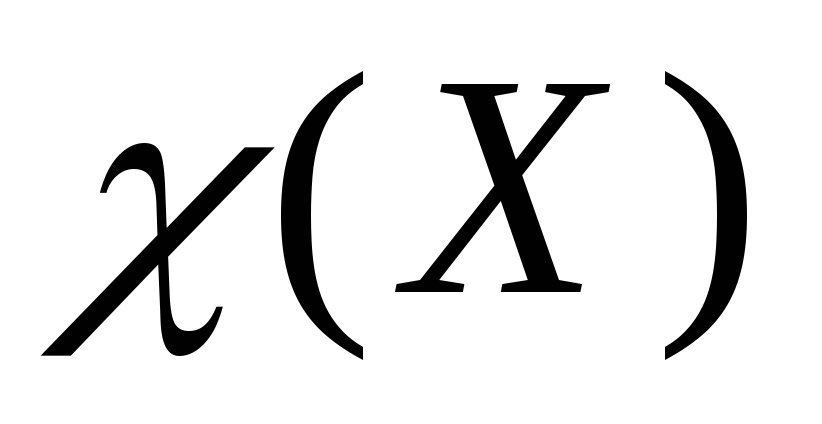 .
Представляет собой отношение количества
вещества данного компонента, выраженного
вмоль
,
к суммарному количеству всех веществ,
входящих в состав раствора, включая
растворитель:
.
Представляет собой отношение количества
вещества данного компонента, выраженного
вмоль
,
к суммарному количеству всех веществ,
входящих в состав раствора, включая
растворитель:
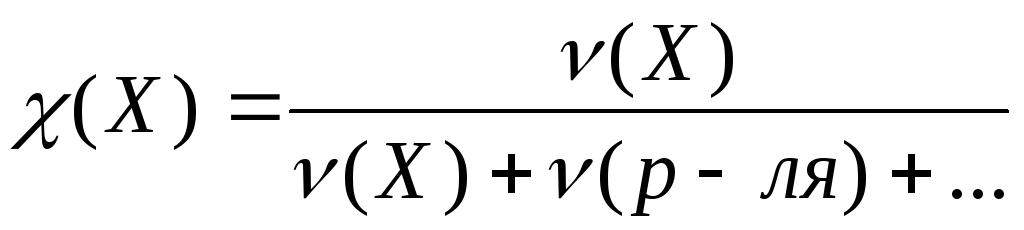 . (9.8)
. (9.8)
− Объемная доля
Обозначается j (Х) . Представляет собой отношение объема данного компонента системы к общему объему системы:
j (Х)= V (X ): V . (9.9)
Может быть безразмерной величиной или выражаться в процентах.
Для перехода от массы раствора к его объему и наоборот нужно знать величину плотности r :
r = m : V . (9.10)
Плотность выражается в г/см 3 (г/мл), кг/м 3 , г/л, и в других единицах.
Для приближенного, но быстрого измерения плотности служит ареометр, или денсиметр, изображенный на рисунке 9.1.
Рисунок 9.1 – Определение плотности жидкости при помощи ареометра
Ареометр представляет собой поплавок с дробью и узкой трубкой. На трубке имеется шкала, проградуированная в единицах плотности. Ареометр погружается в различные жидкости или растворы различной концентрации на разную глубину. При этом вытесняются различные объемы жидкостей, но массы их всегда одинаковы, они равны массе ареометра.
В состоянии равновесия выталкивающая сила, действующая на ареометр, уравновешивается силой тяжести:
F выт. = mg
r ж. × V × g = mg ,
следовательно,
V = m / r ж. .
Итак, объем вытесненной жидкости (или глубина погружения) обратно пропорционален плотности жидкости r ж . Это позволяет проградуировать ареометр, погружая его в растворы с точно известной плотностью, а затем измерять этим ареометром плотности других растворов.
Для измерения плотности жидкость наливают в чистый цилиндр. Из набора выбирают ареометр, который погружается на такую глубину, чтобы уровень жидкости в цилиндре находился в пределах шкалы ареометра. Ареометр не должен касаться дна и стенок цилиндра. Показания следует снимать по нижнему краю мениска в случае прозрачной жидкости, и по верхнему – в случае непрозрачной. Зная плотность раствора, по специальным таблицам можно определить массовую долю раствора, и наоборот, зная концентрацию раствора, определить его плотность. Зависимость массовой доли от концентрации для растворов некоторых солей приведена в таблице 9.1.
Таблица 9.1 – Массовая доля w % и плотность r растворов солей при 20 0 С
|
w % |
r , г/см 3 |
|||||
|
CaCl 2 |
CuSO 4 |
Na 2 CO 3 |
BaCl 2 |
|||
Если в таблице отсутствует необходимое значение величины, то применяют метод интерполяции (нахождение промежуточного значения величины по известным крайним значениям). В данном случае применяется линейная интерполяция: считается, что в узких интервалах зависимость между плотностью и концентрацией линейна. Это является, в некоторой степени, приближением. В действительности возможны и отклонения от линейности.
Допустим, нужно определить плотность 2,3% раствора хлорида натрия. Такой концентрации в таблице нет. Ближайшие значения массовой доли – 2% и 4%, им соответствуют плотности растворов 1,0125 г/см 3 и 1,0226 г/см 3 . Следовательно, при изменении концентрации на 2%, плотность раствора изменится на 1,0226-1,0125=0,0101 г/см 3 . Составив пропорцию, найдем, как изменится плотность при изменении концентрации на 0,3%:
2% _____на 0,0101 г/см 3
0,3% ____на х
Из пропорции х =0,0015 г/см 3 . Прибавив эту величину к значению плотности 2% раствора, получим плотность 2,3% раствора:
1,0125+0,0015=1,0140 г/см 3 .
9.2 Методика проведения опытов
9.2.1 Приготовление раствора с заданной массовой долей соли
Получите у преподавателя задание и рассчитайте, сколько граммов соли и миллилитров воды потребуется для приготовления раствора заданной концентрации. Расчеты проводятся аналогично Примеру 1 в разделе 9.3.
Покажите расчеты преподавателю и получите разрешение на проведение опыта.
Взвесьте на технохимических весах нужную массу соли и высыпьте ее в коническую колбу на 250 мл . Отмерьте цилиндром необходимый объем воды и влейте его в колбу с солью. Перемешивайте содержимое колбы до полного растворения соли.
Перелейте в цилиндр приготовленный раствор. При помощи ареометра измерьте его плотность r экс. . Найдите по таблице 9.1 плотность раствора r таб. , соответствующую заданной концентрации.
Вычислите относительную ошибку опыта:
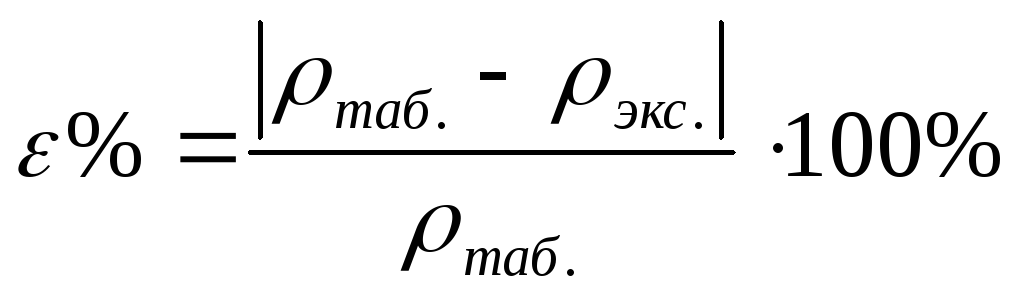
Рассчитайте молярную концентрацию, молярную концентрацию эквивалента, моляльную концентрацию и титр приготовленного раствора.
Результаты опыта и расчетов сведите в таблицу 9.2.
Таблица 9.2 – Результаты опыта
|
Формула соли |
V р-ра , мл |
w % |
Масса соли, г |
V воды , |
r таб. , г/см 3 |
r экс. , г/см 3 |
С(1/ z Х) | |||
9.2.2 Приготовление раствора с заданной массовой долей из более концентрированного раствора
В качестве более концентрированного раствора используется раствор, приготовленный в опыте 9.2.1.
Получите у преподавателя задание. Определите плотность заданного раствора по таблице 9.1. Рассчитайте объем более концентрированного раствора соли и объем воды, необходимые для приготовления раствора заданной концентрации, в соответствии с Примером 2 в разделе 9.3.
Покажите расчеты преподавателю и получите разрешение на выполнение опыта.
Отмерьте цилиндром рассчитанный объем более концентрированного раствора соли и долейте водой до необходимого объема.
Приготовленный раствор тщательно перемешайте, переливая из цилиндра в колбу и обратно. При помощи ареометра измерьте плотность раствора r экс. .
Вычислите относительную ошибку опыта аналогично опыту 9.2.1.
Результаты опыта сведите в таблицу 9.3.
Таблица 9.3 – Результаты опыта
|
w % |
V , мл |
r , г/см 3 |
|||||
|
Исходного раствора |
Заданного раствора |
Исходного раствора |
Заданного раствора |
Исходного раствора |
Заданного раствора |
||
|
r таб. |
r экс. |
||||||
9.3 Примеры решения задач
Рассчитать массу CuSO 4 и объем воды, необходимые для приготовления 130 мл 8% раствора этой соли. Рассчитать молярную, моляльную, нормальную концентрации и титр раствора. Значения плотности взять из таблицы 9.1.
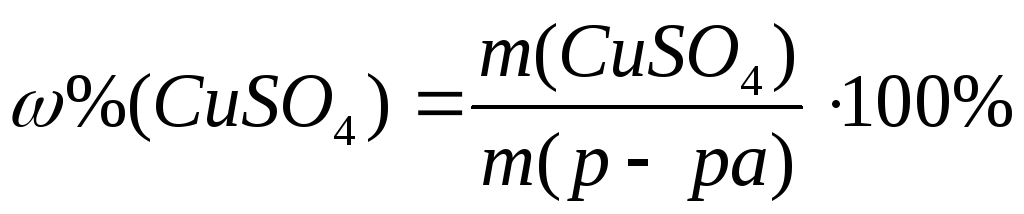 ,
,
m (р-ра)= r× V
В соответствии с данными таблицы 9.1, плотность 8% раствора CuSO 4 равна 1,084 г/ c м 3 (г/мл).
m
(CuSO
4
)=
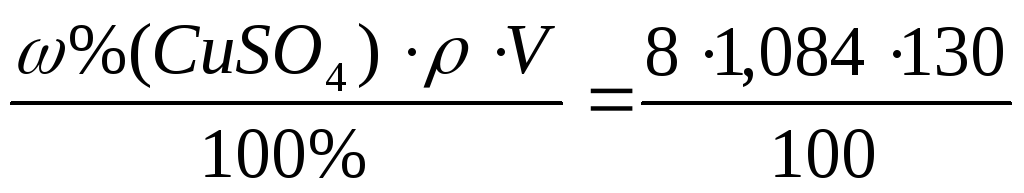 =11,37
(г
)
=11,37
(г
)
m (H 2 O )= m (р-ра)- m (CuSO 4 )= r× V - m (CuSO 4 )= 1,084×130-11,37=129,55(г ).
Так как при комнатной температуре плотность воды близка к 1г/см 3 , то масса воды, выраженная в граммах, численно равна ее объему в мл . Итак, объем воды равен 129,55 мл » 130 мл .
Рассчитаем молярную концентрацию раствора:

Нормальная концентрация:
Моляльная концентрация:

Титр раствора:

Какой объем 8% раствора сульфата меди (II) и какой объем воды требуется для приготовления 110 мл 2% раствора соли?
Задачи этого типа, а также задачи на приготовление растворов заданной массовой доли из двух исходных растворов различных концентраций можно решить, используя правило смешения. Для этого друг под другом записываются процентные концентрации исходных растворов (для чистой воды концентрация соли равна нулю), а правее между ними процентная концентрация заданного раствора. В направлении диагоналей из большей концентрации вычитают меньшую и записывают результат:
Числа 2 и 6 показывают, что для приготовления 110 мл 2% раствора необходимо взять 2 весовые части 8% раствора и 6 весовых частей воды.
Найдем массу 110 мл 2% раствора:
m (2% р-ра)= V (2% р-ра) ×r (2% р-ра)= 110 × 1,019 = 112,1 (г ).
Найдем массу одной весовой части 2% раствора (всего их 2+6=8):
112,1: 8 = 14,01 (г ).
m (8% р-ра) = 14,01 × 2 = 28,02 (г ),
V
(8%
р-ра) =
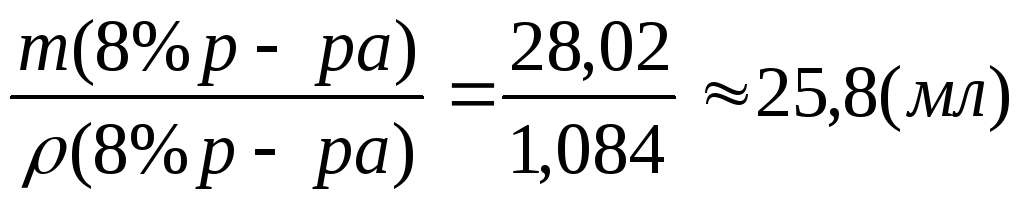
V (H 2 O )= V (2% р-ра) – V (8% р-ра)= 110 – 25,8 = 84,2 (мл ).
Итак, для приготовления 110 мл 2% раствора сульфата меди (II) потребуется 25,8 мл 8% раствора и 84,2 мл воды.
9.4 Требования к уровню подготовки студентов
Знать способы выражения концентрации растворов.
Уметь определять плотность раствора при помощи ареометра.
Уметь пользоваться таблицами зависимости плотности растворов от массовой доли растворенного вещества.
Уметь производить расчеты, необходимые для приготовления растворов заданной концентрации, выраженной различными способами.
Уметь готовить растворы заданной концентрации из сухого вещества и воды; из более концентрированного раствора и воды.
Уметь находить массу или количество растворенного вещества, исходя из концентрации раствора.
Уметь производить расчеты, связанные с переходом от одного способа выражения концентрации раствора к другому.
9.5 Задания для самоконтроля
9.5.1 Сколько граммов гидроксида калия нужно растворить в 600 мл воды для получения 16% раствора?
9.5.2 Какой объем 4% раствора хлорида кальция (плотность в таблице 9.1) требуется для взаимодействия с 120 мл 0,1М раствора AgNO 3 ?
9.5.3 Определите массовую долю растворенного вещества в 2,64н. растворе серной кислоты. Плотность раствора серной кислоты равна 1,080 г/мл .
9.5.4 Какие объемы 12% раствора и 3% раствора хлорида натрия нужно смешать для получения 120 мл 8% раствора? При решении задачи воспользоваться данными таблицы 9.1.
9.5.5 Какой из перечисленных растворов содержит 0,27 моль растворенного вещества в 300 мл воды:
а) раствор CuSO 4 с моляльной концентрацией 0,0009 моль/кг ;
б) раствор K 2 SO 4 с моляльной концентрацией 0,27 моль/кг ;
в) раствор ZnCl 2 с моляльной концентрацией 0,081 моль/кг ;
г) раствор Al 2 (SO 4 ) 3 с моляльной концентрацией 0,9 моль/кг ?
9.5.6 Какова величина нормальной концентрации водного раствора хлорида алюминия, если массовая доля растворенного вещества составляет 0,02? Плотность раствора 1,0164 г/см 3 .
9.5.7 В трех литрах какого из перечисленных растворов содержится 2,4 моль растворенного вещества:
а) 0,8 М раствор NH 4 Cl ;
б) 1,2 М раствор CaCl 2 ;
в) 7,2 М раствор NaOH ;
г) 1,25 М раствор H 2 SO 4 ?
9.5.8 Какова величина моляльной концентрации водного раствора ортофосфорной кислоты, если массовая доля растворенного вещества составляет 0,06?
9.5.8 Какая масса хлорида калия растворена в 180 граммах воды, если процентная концентрация по массе составляет 10%?
9.5.9 Какова величина титра водного раствора хлорида натрия, если массовая доля растворенного вещества составляет 0,1? Плотность раствора равна 1,0707 г/см 3 .
9.5.10 Какова величина мольной доли сульфата меди (II) в водном растворе, если массовая доля растворенного вещества составляет 0,12?
9.5.11 Какая масса серной кислоты содержится в двух литрах раствора, титр которого равен 0,08 г/см 3 ?
9.6.1 Романцева Л.М. Сборник задач и упражнений по общей химии/ Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. – М.: Высш. шк., 1991. – С.101 – 104.
Лабораторная работа №1
«Приготовление растворов с заданной концентрацией»
Цель работы : научиться взвешивать вещества; приготовить раствор соли заданной концентрации.
Оборудование и реактивы : стакан химический, стеклянная палочка, измерительный цилиндр, весы с разновесами, кристаллический хлорид натрия, вода.
Техника безопасности : соблюдайте осторожность при работе со стеклянной посудой!
Что такое раствор?
Что такое концентрация раствора?
Как вычисляется массовая доля растворенного вещества?
Перечислите области применения растворов
Ход работы
Задание 1.Рассчитайте, какую массу хлорида натрия и какой объем воды надо взять для приготовления 150 г 3 % раствора хлорида натрия.
Задание 2.Приготовьте раствор согласно задания 1.
1. Приведите в равновесие чашечки весов.
2. Отвесьте рассчитанную массу соли.
3. С помощью мензурки отмерьте рассчитанный объем воды.
4. В химическом стакане растворите соль в воде, перемешивая раствор стеклянной палочкой.
Задание 3.Добавьтек полученному раствору 150 г. воды.
1. Рассчитайте, как при этом изменится концентрация раствора (массовая доля растворенного вещества).
2. Запишите в тетрадь необходимые расчеты, сделайте по итогам работы вывод.
1. Вычислите массу гидроксида натрия и воды, которые требуются для приготовления 5кг 10%-ого раствора?
2. Определите массу азотной кислоты, которая содержится в 250мл её раствора с массовой долей растворенного вещества 20% (плотность азотной кислоты составляет 1, 115г/мл)
Цель работы: научиться
- готовить растворы заданной концентрации;
- производить пересчеты концентраций растворов;
Задание:
– Приготовить 100 мл раствора NaCl с массовой долей вещества указанной преподавателем.
– Измерить ареометром плотность приготовленного раствора и определить его истинную концентрацию.
Выполнение опыта.
1. Вычисляют массу хлорида натрия, необходимую для приготовления 100 мл раствора заданной массовой доли вещества. Плотность раствора данной концентрации находят по справочнику. Если в таблице отсутствует плотность этого раствора, то ее находят методом интерполяции.
Пример: Допустим необходимо приготовить раствор NaCl с ω = 3%. В таблице даны плотности растворов с ω 4% и 2%. Выписывают данные и находят разность (Δ) величин:
----------------------
Из этого следует, что изменению концентрации 2% соответствует изменение плотности 0,0182. В узком интервале концентраций зависимость плотности от концентрации можно считать линейной, поэтому составляем пропорцию
х – 1% х = 0,0091,
значит, плотность раствора с ω 3% равна 1,0250 (, или ).
2. Взвешивают на технохимических весах рассчитанную массу вещества, переносят навеску в мерную колбу на 100,0 мл. Вещество полностью растворяют в небольшом объеме воды, затем доводят объем раствора водой до метки.
Измерение плотности раствора ареометром. Ареометр - прибор для измерения плотности растворов. Он представляет собой стеклянный поплавок, в верхней узкой части которого имеется шкала с делениями, указывающими плотность. Каждый ареометр предназначен для жидкостей, плотность которых лежит в определенных пределах. Поэтому ареометр необходимо подбирать по ориентировочной плотности приготовленного раствора. Для измерения плотности раствор наливают в мерный цилиндр и осторожно опускают ареометр: ареометр не должен касаться стенок цилиндра, а свободно плавать в растворе. По шкале ареометра производят отсчет плотности по нижнему краю мениска. Ареометр позволяет определить плотность с точностью ± 0,003. Измеряют плотность приготовленного раствора ареометром и устанавливают концентрацию его (при необходимости проводят интерполяцию).
3. Пересчитайте массовую долю раствора на другие концентрации, заполните таблицу:
| w(теор.) | r(теор.) | m(р-ра) | m(р.в.) | r(эксп.) | w(эксп.) | n(р.в.) | cм | cэ | cm | N(р.в.) | n(воды) | N(воды) |
4.Вывод.
Конец работы -
Эта тема принадлежит разделу:
Лабораторные работы по химии
для студентов курса ИТИ... ОГЛАВЛЕНИЕ... ПРАВИЛА РАБОТЫ В ХИМИЧЕСКОЙ ЛАБОРАТОРИИ...
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
Общие правила работы в лаборатории
Выполнение лабораторных работ связано с использованием разнообразного оборудования, химических реактивов, химической посуды, которые при неумелом обращении способны нанести травмы и
Лабораторный журнал
Записи в журнале производят только чернилами, лаконично, аккуратно и обязательно непосредственно после проведения опыта.
Не разрешается вести записи, расчеты на черновиках,
Реактивы и правила обращения с реактивами
По степени чистоты реактивы делятся на технические (техн.), чистые (ч.), чистые для анализа (ч.д.а.), химически чистые (х.ч.).
Необходимые для работы реактивы выставляются
Меры предосторожности при работе в лаборатории
К проведению опыта следует приступать после внимательного ознакомления с его содержанием и уяснения техники его выполнения.
Опыты с ядовитыми и неприятно пахнущими вещества
Оказание первой помощи
При попадании на кожу концентрированных кислот следует тотчас же смыть ее большим количеством воды из крана, а затем обработать пораженный участок 2%-м раствором питьевой соды.
Опыт 2. Гидролиз солей. Реакция cреды в растворах различных солей.
Цель работы: опытным путем изучить реакцию гидролиза солей
Задание: 1.Используя нейтральный раствор лакмуса, определите реакцию сре
Названия комплексных солей
формула вещества
название химическое
название эмпирическое
K4
Гексациано
Опыт 2. Определение знака заряда частиц золя
В окрашенных золях знак заряда частиц можно определить методом капиллярного анализа. Он основан на том, что целлюлозные стенки капилляров фильтровальной бумаги заряжены отрицательно
Определение знака заряда частиц золя
№
объем раствора,мл
реактив в избытке
состав ядра
потенциал определяющие ионы
знак заряда
Опыт 4. Получение золя гидроксида железа (III) методом пептизации
Приготовьте осадок гидроксида железа действием раствора щелочи на раствор хлорида железа (III). Напишите уравнение реакции в молекулярной и ионно-молекулярной формах.
Отделите осадок гидро
Отношение металлов к кислотам
Кислоты - электролиты, образующие при диссоциации катионы только одного вида - катионы водорода Н++. Поэтому процесс электролитической диссоциации кислот в общем виде мож
NO3¯ + ne- ––> продукты восстановления
кол-во е- -нов:
+le-
+ 3e-
+ 5e-
+8e-
Продукты
SO42- + ne- –––––– > продукты восстановления
кол-во е- -нов:
+2е-
+6е-
+8e-
Продукты:
SO2
Опыт 2. Взаимодействие металлов с концентрированной серной кислотой
(Опытпроводится в вытяжном шкафу)
В три пробирки налейте по 1-2 мл концентрированной серной кислоты (осторожно!). Внесите в о
Опыт 3. Получение гидроксидов металлов и изучение их кислотно - основных свойств
В шесть пробирок внесите по 3 - 4 капли растворов солей магния, цинка, алюминия и меди (порцию каждой соли в две пробирки). К растворам прилейте по каплям до прекращения образования осадков раствор
Опыт 4. Химическая и электрохимическая коррозия цинка. Влияние образования микрогальванопар на скорость коррозии цинка
а) В две пробирки налейте по 3-4 мл 2н. раствора соляной кислоты и внесите по одной грануле цинка. Наблюдайте выделение газа в пробирках. Составьте химическое и электронно - ионое у
Опыт 5. Коррозия оцинкованного и луженого железа в кислой среде.
В две пробирки налейте по 4-5 мл. дистиллированной воды, добавьте в каждую по 3 капли 2н раствора серной кислоты и по 2 капли К3[ Fe(CN)6] . Нанесите скальпел
Опыт 3 . Образование Са(ОН)2 при твердении портландцемента.
В фарфоровую чашку поместите немного порошка портландцемента и добавьте 1-2 капли фенолфталеина. Показывает ли фенолфталеин щелочную среду?
К этой порции порошка цемента до
Опыт 4. Изучение качественного состава водной вытяжки портландцемента.
Насыпьте в пробирку небольшую порцию порошка цемента (0,5 - 1 см. высотой), прилейте дистиллированной воды до половины объема и хорошо перемешайте стеклянной палочкой. Дайте образов
Опыт 5. Ускорение процесса схватывания портландцемента.
В три фарфоровые чашки поместите по 5 г. порошка портландцемента и затворите каждую порцию отдельно одинаковыми объемами следующих растворов, так чтобы образовалось тесто:
первую -